Imagen elaborada por@coolxxx
Ante de conocer el modelo de Bohr, debemos saber acerca del papel que juega la mecánica cuántica, cuando hablamos de átomos, ya que esta disciplina que forma parte de la física en referencia a los fenómenos que involucran los átomos y la naturaleza a pequeñas escala.
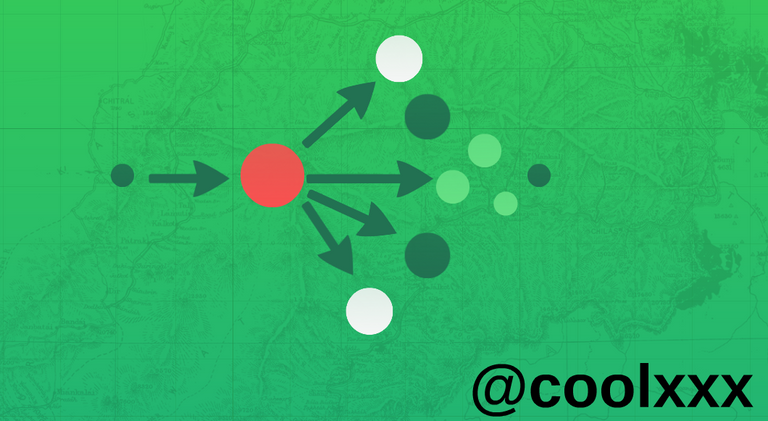
Radiaciones de los átomos. El átomo de hidrógeno Componentes α, las transiciones M--- M±1 y -M±1. En consecuencia, por ejemplo, en la observación trasversal del efecto las intensidades de los componentes π son propiedades a
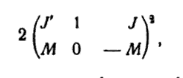
Y las intensidades de las componentes α lo son las sumas (recordemos que cambiar de signo todos los números de la segunda fila, los símbolos-3j pueden cambiar únicamente de signo, con lo que no varían sus cuadrados). En una campo exterior, incluso si es débil, el momento cinético J deja en rigor de conservarse; en un campo uniforme se cumple de manera exacta únicamente la conservación de la proyección del momento M. por ello, también en las transiciones radiactivas en un campo débil la conservación del momento cinético se convierte en algo no necesario y en el espectro de los átomos pueden aparecer rayas prohibidas por las reglas ordinarias de slección.
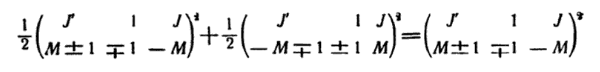
Cita tomada del libro: Teoría cuántica relativista - Parte1 - Página 201 por V. B. Berestetskii, Evgeniĭ Mikhaĭlovich Lifshit︠s︡, Lev Petrovich Pitaevskii - 1975.
Con la afirmación anterior, nos sirve para dar mejor entendimiento, por que al igual que la luz, la materia muestra propiedades de fenómenos de ondas por medios de sus partículas, a nivel cuántico la longitud de onda de los objetos masivos es muy pequeña, para varios físico y científico consideran en algunos caso no lo ven como onda por su nivel de escala.
Modelo de Bohr
Aunque el modelo atómico de Rutherford explica la distribución de cargas positivas y negativas en el átomo, presenta un grave problema de inestabilidad. De acuerdo con las leyes de la física clásica, el electrón al girar alrededor del núcleo se acelera perdiendo energía constantemente hasta precipitarse en el núcleo, se comprueba de forma experimental que los átomos son estables y los electrones no caen sobre el núcleo.
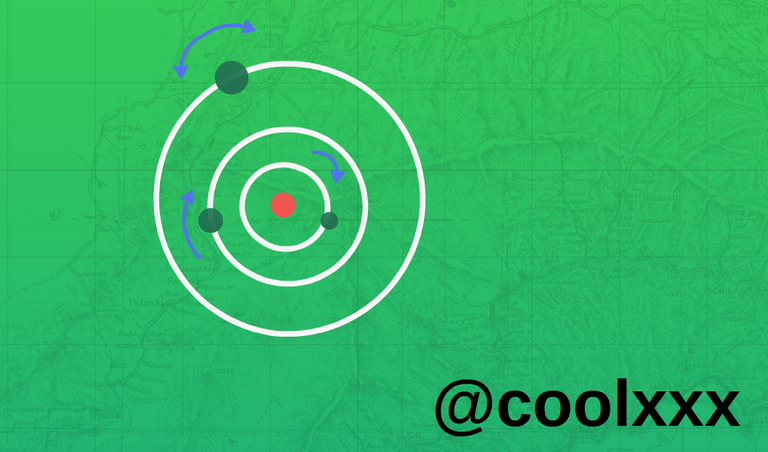
Imagen elaborada por@coolxxx
El fenómeno de la luz ante de penetrar en un prisma, pasando en un medio de gas incandescente en su espectro aparecen líneas negras.
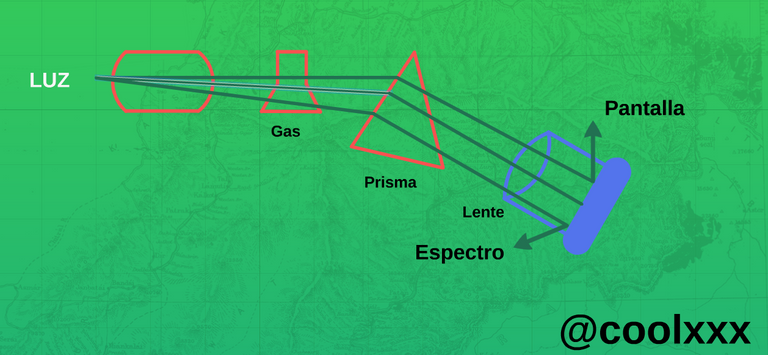
Imagen elaborada por@coolxxx
También que debería ser debidos a una masa que chocan con otra, gracias a que la luz considerando que es una masa que llevaba una onda asociada y que cada partícula es un fotón poseía una energía a E=h.v, donde h es una constante de Planck y v es la frecuencia de la luz.
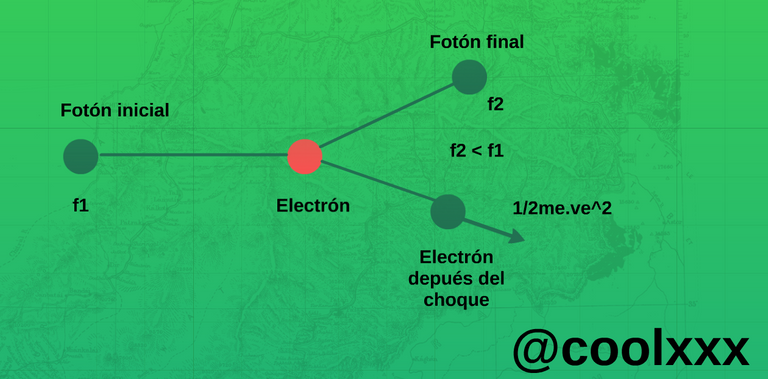
Imagen elaborada por@coolxxx
Considerando y la observación de una series de experimentos sobre los fenómenos físicos ya enunciado anteriormente, el Johann Balmer, en 1885 encontró una fórmula matemática que se ajusta a las rayas negras que daban el espectro de la luz blanca, que atraviesa el gas de hidrogeno de la siguiente manera :
V= R(1/4-1/n^2)
Veamos primero por qué desecharse el modelo atómico de Rutherford, había dos tipos de hechos experimentales que se contradecían, el modelo de Reutherford ofrecía una explicación a los experimentos de difracción de partículas alfa, pero no concordaba con un gran número de experimentos relacionados con la carga eléctrica. Estos experimentos habían demostrados hasta la saciedad que los objetos con cargas eléctricas de signo contrarios se atraen si no hay ninguna fuerza que lo mantenga separados; los objetos se mueven el uno hacia el otro y cuando ambos están en contactos sus cargas se neutralizan.
Cita tomada del libro: Química: experimentos y teorías Por Paul R. O'Connor página 159, 1982.
Logrando en la siguiente justificación donde el electrón no caiga sobre el núcleo, con diferente niveles de energía, este están presente en un fenómeno de espectro óptico, para poder permitir explicar la diferente forma de comportamiento de la serie espectrales del hidrógeno, que pueden interpretarse como transiciones entre los diferente niveles energético, de tal modo que la energía de ionización y los espectros de los iones hidrogenoides, el cual está en un solo electrón. Logrando experimentar que también se pueden presentar en una órbita descrita por electrón es un múltiplo entero de h/2π, la energía liberada al pasar el electrón de una órbita, más alejada a otra más cercana al núcleo se emite en forma de una onda electromagnética elemental, bajo la presencia de fotones en una frecuencia dada por su propia intensidad de onda.
Bibliografía
Teoría cuántica relativista - Parte1 - Página 201 por V. B. Berestetskii, Evgeniĭ Mikhaĭlovich Lifshit︠s︡, Lev Petrovich Pitaevskii - 1975.
Química: experimentos y teorías Por Paul R. O'Connor página 159, 1982.
